탄산수소나트륨이 가수분해 시 알칼리성인 이유는?
화학/화학 2019. 8. 22. 14:29
NaHCO3 + H2O → 알칼리성 ?
의문 : 탄산은 약산인데 왜 가수분해 시 알칼리성을 띄는 것인가?
Q1 : 탄산이 약산인 이유는?
A : H2CO3 + H2O ⇔ H3O+ + HCO3-
H2CO3 → HCO3- Ka = 4.4 × 10-7 / pKa = 6.35
H3O+ → H2O Ka = 5.6 × 10-11 / pKa = -1.74
H2O의 pKa가 더 작으므로 H2CO3보다 더 센산이다.
센산은 H+ 이온을 내 놓으려한다.
따라서 반응은 오른쪽으로 덜 진행될 것이다.
탄산이 약산인 이유이다.
H2CO3 → HCO3- Ka = 4.4 × 10-7 / pKa = 6.35
H3O+ → H2O Ka = 5.6 × 10-11 / pKa = -1.74
H2O의 pKa가 더 작으므로 H2CO3보다 더 센산이다.
센산은 H+ 이온을 내 놓으려한다.
따라서 반응은 오른쪽으로 덜 진행될 것이다.
탄산이 약산인 이유이다.
생각1 : 탄산수소나트륨의 가수분해 반응식은?
A : NaHCO3 + H2O ⇔ NaOH + H2CO3
H2CO3- + H2O ⇔ H3O+ + HCO3-
HCO3- + H2O ⇔ H3O+ + CO32-
H2CO3- + H2O ⇔ H3O+ + HCO3-
HCO3- + H2O ⇔ H3O+ + CO32-
이렇게 산성을 띄지 않을까 하고 생각
여기서 오류1. 이 식이 맞는가?
오류2. 이온으로 표시해야한다.
이유 ↓
여기서 오류1. 이 식이 맞는가?
오류2. 이온으로 표시해야한다.
이유 ↓
이온성 물질(염)이 물에 녹으면 독립적인 양이온과 음이온으로 분해된다.
이온성 고체가 물에 녹으면 이온들은 수화되어 흩어진다.
(줌달 일반화학 10th p.144)
생각2 : 탄산수소나트륨의 가수분해 반응식은?
A : NaHCO3 + H2O ⇔ Na+ + HCO3- + H+ + OH-
HCO3- + H2O ⇔ H2CO3 + OH-
HCO3- + H2O ⇔ H2CO3 + OH-
H2CO3 ⇔ HCO3- pKa1 = 6.35
HCO3- ⇔ H2CO3 Kb = Kw/Ka = 2.238 x 10-8 / pKb = 7.65
HCO3- ⇔ H2CO3 Kb = Kw/Ka = 2.238 x 10-8 / pKb = 7.65
pKb가 7.65 이고 완전히 해리되지 않고 OH- 이온을 내놓으니
알칼리성 일 것이다.
알칼리성 일 것이다.
생각3 : HCO3-가 산으로 작용한다면?
A : NaHCO3 +H2O ⇔ Na+ + HCO3- + H+ + OH-
HCO3- + H2O ⇔ CO32- + H3O+
HCO3- + H2O ⇔ CO32- + H3O+
HCO3- ⇔ CO32- pKa2 = 10.3
H2O ⇔ H3O+ pKa = -1.74
H2O ⇔ H3O+ pKa = -1.74
역반응이 우세할 것으로 예상.
"약한 산과 염기로 이루어진 염은 약한 산의 음이온이 가수 분해하여 수용액이 염기성을 나타내게 된다."
(약산의 음이온은 염기이다.)
에 근거하여
결론적으로 알칼리성이다.
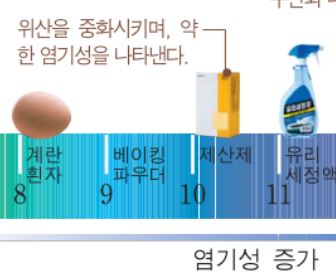
애초에 탄산수소나트륨은 pH 8~9로 약염기여서 가수분해 시 염기성이 맞다.
'화학 > 화학' 카테고리의 다른 글
| 화학 영단어 (0) | 2019.11.10 |
|---|---|
| 부분압력 평형상수 Kp (0) | 2019.08.21 |
| 격자에너지 (lattice) 와 수화에너지 (hydration energy) (0) | 2019.08.14 |
| 포화, 불포화, 과포화 용액 (0) | 2019.08.14 |
| 라울의 법칙 (Raoult's law) (0) | 2019.08.14 |